FDA批准新设备,术中监测乳腺癌是否有残留
发布日期:2024-04-19FDA 已批准 Lumisight(pegulicianine)的新药申请和 Lumicell 直接可视化系统(DVS)的上市申请。该产品适用于成年乳腺癌患者的荧光成像,作为肿瘤切除手术中切除原发标本后术中检测切除腔内癌组织的辅助手段。
Lumisight 药物和 Lumicell DVS 系统统称为 LumiSystem。这标志着第一个也是唯一一个专门设计用于检测最重要的乳腔内癌组织的成像组合产品。
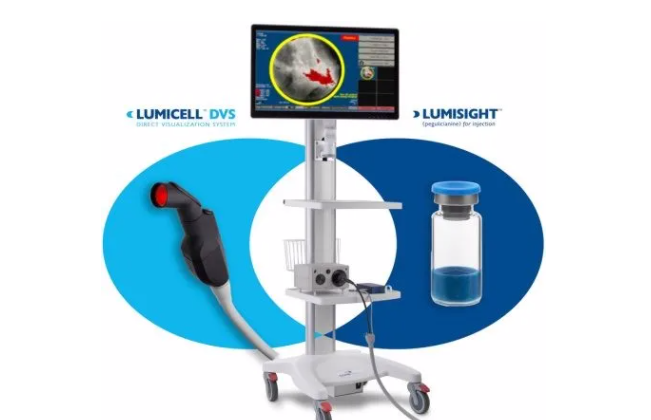
根据之前的数据,Lumisight 在实时检测残留癌症方面显示出 84% 的诊断准确率。该产品的工作原理是识别在肿瘤切除术中可能遗漏的残留疾病,从而可能使一些患者无需接受额外的手术。该系统的安全性是通过在美国各地进行的 5 项临床试验中使用的 700 多名乳腺癌患者的数据来确定的。
对于不良事件 (AE),常见的包括过敏和尿液颜色异常。此外,Lumisight 可能会引起严重的超敏反应,包括过敏反应。来自关键 INSITE 试验的附加数据用于支持系统的功效。在此,406 名患者接受了 1.0 mg/kg 静脉注射pegulicianine 治疗,然后进行肿瘤切除术。共有 316 人患有浸润性癌症,76 人患有原位癌。
总体而言,在乳腺癌手术中使用pegulicianine荧光引导手术达到了去除残留肿瘤特异性的预先设定的阈值。然而,它没有达到预先设定的灵敏度阈值。“在肿瘤切除手术中,外科医生仍然很难在第一次手术中识别并切除所有肿瘤,”麻省总医院乳腺项目主任、哈佛医学院外科教授Barbara Smith博士说,“借助 LumiSystem,我们现在将拥有一项经过临床证明可以在肿瘤切除术中实现更完整的癌症切除的技术,从而帮助一些患者避免二次手术。”我们对 Lumisight 和 Lumicell DVS 获得双重批准感到非常自豪。
我们相信,这是十多年来第一个获得批准的药物器械组合产品,符合 FDA 最严格的新药和审查流程,经过 FDA 的批准,LumiSystem 现在是第一个也是唯一一个能够检测乳腔内最重要的癌组织的成像组合产品。





